Επιλέξτε τα ισχυρότερα οξειδωτικά
Πριν προσδιορίσουμε τα ισχυρότερα οξειδωτικά, θα προσπαθήσουμε να μάθουμε τα θεωρητικά ερωτήματα σχετικά με αυτό το θέμα.

Ορισμός
Στη χημεία, ένας οξειδωτής σημαίνει ουδέτερα άτομα ή φορτισμένα σωματίδια, τα οποία, στη διαδικασία χημικής αλληλεπίδρασης, παίρνουν ηλεκτρόνια από άλλα σωματίδια.
Παραδείγματα οξειδωτικών
Προκειμένου να καθοριστεί η ισχυρότερηοξειδωτικών, πρέπει να σημειωθεί ότι αυτός ο δείκτης εξαρτάται από τον βαθμό οξείδωσης. Για παράδειγμα, σε υπερμαγγανικό κάλιο σε μαγγάνιο είναι +7, δηλαδή είναι μέγιστο.
Αυτή η ένωση, πιο γνωστή ωςυπερμαγγανικό κάλιο, παρουσιάζει χαρακτηριστικές οξειδωτικές ιδιότητες. Είναι το υπερμαγγανικό κάλιο που μπορεί να χρησιμοποιηθεί στην οργανική χημεία για να πραγματοποιήσει ποιοτικές αντιδράσεις σε έναν πολλαπλό δεσμό.
Ορίζοντας τα ισχυρότερα οξειδωτικά, θα σταματήσουμεεπί του νιτρικού οξέος. Είναι σωστά ονομάζεται βασίλισσα των οξέων, επειδή είναι αυτή η ένωση, ακόμη και σε αραιωμένη μορφή, ικανή να αλληλεπιδρά με μέταλλα που βρίσκονται στην ηλεκτροχημική σειρά μεταλλικών τάσεων μετά το υδρογόνο.
Λαμβάνοντας υπόψη τα ισχυρότερα οξειδωτικά, δεν μπορεί κανείς να αγνοήσει τις ενώσεις χρωμίου. Τα άλατα χρωμίου θεωρούνται ένα από τα λαμπρότερα οξειδωτικά, χρησιμοποιούνται στην ποιοτική ανάλυση.

Ομάδες οξειδωτικών
Ως οξειδωτικά είναι δυνατόν να ληφθούν υπόψη καιουδέτερα μόρια και φορτισμένα σωματίδια (ιόντα). Εάν αναλύσουμε τα άτομα των χημικών στοιχείων που παρουσιάζουν παρόμοιες ιδιότητες, τότε είναι απαραίτητο στο εξωτερικό επίπεδο ενέργειας να περιέχουν από τέσσερα έως επτά ηλεκτρόνια.
Γίνεται κατανοητό ότι τα ρ-στοιχεία έχουν φωτεινά χαρακτηριστικά οξειδώσεως και τυπικά μη-μέταλλα σχετίζονται με αυτά.
Το ισχυρότερο οξειδωτικό είναι το φθόριο, ένας εκπρόσωπος της υποομάδας αλογόνου.
Μεταξύ των ασθενών οξειδωτικών μπορεί να ληφθεί υπόψηεκπροσώπους της τέταρτης ομάδας του περιοδικού πίνακα. Υπάρχει μια τακτική μείωση των οξειδωτικών ιδιοτήτων στις κύριες υποομάδες καθώς η ακτίνα του ατόμου αυξάνεται.
Λαμβάνοντας υπόψη αυτό το μοτίβο, μπορεί να σημειωθεί ότι η οξείδωση του μολύβδου είναι ελάχιστη.
Το ισχυρότερο μη μεταλλικό οξειδωτικό είναι το φθόριο, το οποίο δεν είναι ικανό να δώσει ηλεκτρόνια σε άλλα άτομα.
Στοιχεία όπως το χρώμιο, το μαγγάνιο, ανάλογα με το περιβάλλον στο οποίο λαμβάνει χώρα η χημική αλληλεπίδραση, μπορούν να εκδηλώσουν όχι μόνο οξειδωτικές αλλά και μειωτικές ιδιότητες.
Μπορούν να αλλάξουν τον βαθμό οξείδωσης από μια μικρότερη τιμή σε μια μεγαλύτερη, δίνοντας τα ηλεκτρόνια σε άλλα άτομα (ιόντα) γι 'αυτό.
Τα ιόντα όλων των ευγενών μετάλλων, ακόμη και σε έναν ελάχιστο βαθμό οξείδωσης, εμφανίζουν φωτεινές οξειδωτικές ιδιότητες, εισερχόμενοι ενεργά σε χημική αλληλεπίδραση.
Μιλώντας για ισχυρά οξειδωτικά, θα είναι λάθοςνα αγνοήσει το μοριακό οξυγόνο. Αυτό το διατομικό μόριο θεωρείται ένας από τους πιο προσιτούς και ευρέως διαδεδομένους τύπους οξειδωτικών, επομένως χρησιμοποιείται ευρέως στην οργανική σύνθεση. Για παράδειγμα, παρουσία ενός οξειδωτή στη μορφή μοριακού οξυγόνου, η αιθανόλη μπορεί να μετατραπεί σε αιθανόλη, η οποία είναι απαραίτητη για την επακόλουθη σύνθεση οξικού οξέος. Με τη βοήθεια της οξείδωσης, είναι δυνατόν να πάρουμε ακόμη και οργανική αλκοόλη (μεθανόλη) από το φυσικό αέριο.
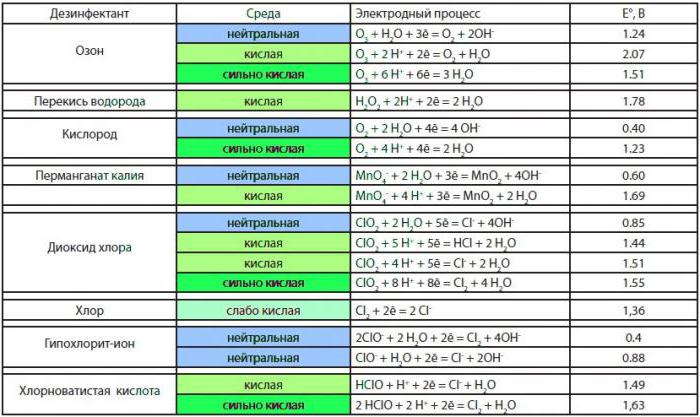
Συμπέρασμα
Οι διαδικασίες οξείδωσης-αναγωγής έχουνσημαντικό όχι μόνο για την πραγματοποίηση ορισμένων μετασχηματισμών στο χημικό εργαστήριο αλλά και για τη βιομηχανική παραγωγή διαφόρων οργανικών και ανόργανων προϊόντων. Γι 'αυτό είναι τόσο σημαντικό να επιλέγονται τα σωστά οξειδωτικά ώστε να αυξάνεται η αποτελεσματικότητα της αντίδρασης, για να αυξάνεται η απόδοση του προϊόντος αντίδρασης.













