Ηλεκτροφιλική προσθήκη στην οργανική χημεία
Οι αντιδράσεις προσκόλλησης χαρακτηρίζονται από το σχηματισμόμία χημική ένωση από δύο ή περισσότερα από τα αρχικά υλικά. Θεωρούμε ότι ο μηχανισμός της ηλεκτρόφιλης προσθήκης είναι βολικός για παράδειγμα των αλκενίων - ακόρεστων ακυκλικών υδρογονανθράκων με έναν διπλό δεσμό. Εκτός από αυτούς, άλλοι υδρογονάνθρακες με πολλαπλούς δεσμούς, συμπεριλαμβανομένων κυκλικών, εισέρχονται σε τέτοιους μετασχηματισμούς.
Στάδια αλληλεπίδρασης των αρχικών μορίων
Η ηλεκτροφική σύνδεση πραγματοποιείται σε πολλάστάδια. Το ηλεκτρόφιλο, το οποίο έχει ένα θετικό φορτίο, ενεργεί ως δέκτης ηλεκτρονίων και ο διπλός δεσμός του μορίου αλκενίου παίζει το ρόλο ενός δότη ηλεκτρονίων. Και οι δύο ενώσεις σχηματίζουν πρώτα ένα ασταθές σύμπλοκο ρ. Στη συνέχεια αρχίζει ο μετασχηματισμός του π-συμπλόκου στο σύμπλοκο.. Ο σχηματισμός της καρβοκατασκευής σε αυτό το στάδιο και η σταθερότητά της καθορίζουν το ρυθμό αλληλεπίδρασης στο σύνολό της. Μετά από αυτό, η καρβοξυλάση αλληλεπιδρά γρήγορα με ένα μερικώς αρνητικά φορτισμένο πυρηνόφιλο και σχηματίζεται το τελικό προϊόν του μετασχηματισμού.

Η επίδραση των υποκαταστατών στο ρυθμό αντίδρασης
Αποεπεξεργασία του φορτίου (ϭ +) στην καρότσααπό τη δομή του αρχικού μορίου. Η θετική επαγωγική επίδραση που εμφανίζει η αλκυλική ομάδα οδηγεί σε χαμηλότερο φορτίο του γειτονικού ατόμου άνθρακα. Ως αποτέλεσμα, στο μόριο με έναν υποκαταστάτη δότη ηλεκτρονίων, αυξάνεται η σχετική σταθερότητα του κατιόντος, η ηλεκτρονική πυκνότητα του π-δεσμού και η αντιδραστικότητα του μορίου στο σύνολό του. Η επίδραση των δεκτών ηλεκτρονίων στην αντιδραστικότητα θα είναι αντίθετη.
Ο μηχανισμός προσθήκης αλογόνου
Ας αναλύσουμε λεπτομερέστερα τον μηχανισμό της αντίδρασης της ηλεκτρόφιλης προσθήκης με το παράδειγμα της αλληλεπίδρασης αλκενίου και αλογόνου.
- Το μόριο αλογόνου προσεγγίζει έναν διπλό δεσμόμεταξύ ατόμων άνθρακα και είναι πολωμένο. Λόγω ενός μερικώς θετικού φορτίου στο ένα άκρο του μορίου, το αλογόνο έλκει ηλεκτρόνια π-δεσμού. Έτσι σχηματίζεται το ασταθές π-σύμπλεγμα.
- Στο επόμενο βήμα, το ηλεκτρόφιλο σωματίδιο συνδυάζεται με δύο άτομα άνθρακα για να σχηματίσει έναν κύκλο. Εμφανίζεται ένα κυκλικό ιόν "ονίου".
- Το υπόλοιπο φορτισμένο σωματίδιο αλογόνο(ένα θετικά φορτισμένο πυρηνόφιλο) αλληλεπιδρά με ιόν όντου και συνδέεται στην αντίθετη πλευρά του προηγούμενου σωματιδίου αλογόνου. Το τελικό προϊόν, trans-1,2-dihalogenalkane, εμφανίζεται. Ομοίως, η προσθήκη αλογόνου σε κυκλοαλκένιο.
Ο μηχανισμός προσθήκης υδροαλογονικών οξέων

Αντιδράσεις ηλεκτροφιλικής προσθήκηςΤα αλογονίδια του υδρογόνου και το θειικό οξύ προχωρούν διαφορετικά. Σε ένα όξινο μέσο, το αντιδραστήριο διασπάται σε ένα κατιόν και ένα ανιόν. Ένα θετικά φορτισμένο ιόν (ηλεκτρόφιλο) επιτίθεται στον π-δεσμό, συνδυάζεται με ένα από τα άτομα άνθρακα. Μια μορφή σχηματισμού άνθρακα στην οποία το γειτονικό άτομο άνθρακα φορτίζεται θετικά. Περαιτέρω, η καρβοτοξίωση αντιδρά με το ανιόν για να σχηματίσει το τελικό προϊόν αντίδρασης.
Η κατεύθυνση της αντίδρασης μεταξύ των ασύμμετρων αντιδραστηρίων και του κανόνα Markovnikov

Ηλεκτροφιλική σύνδεση μεταξύ δύοτα ασυμμετρικά μόρια προχωρούν τοπικώς επιλεκτικά. Αυτό σημαίνει ότι σχηματίζεται μόνο ένα από τα δύο πιθανά ισομερή. Η περιφερικότητα περιγράφει τον κανόνα του Markovnikov, σύμφωνα με τον οποίο το υδρογόνο συνδέεται με ένα άτομο άνθρακα συνδεδεμένο με ένα μεγάλο αριθμό άλλων ατόμων υδρογόνου (σε ένα περισσότερο υδρογονωμένο).
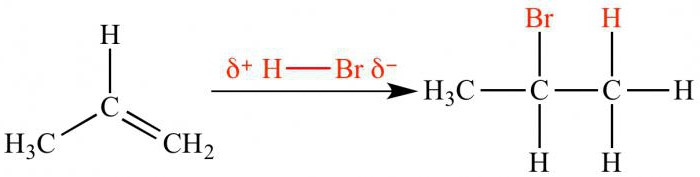
Για να κατανοήσουμε την ουσία αυτού του κανόνα, πρέπει να θυμόμαστεότι ο ρυθμός αντίδρασης εξαρτάται από τη σταθερότητα του ενδιάμεσου άνθρακα. Η επίδραση των υποκαταστατών δότη ηλεκτρονίων και δέκτη συζητήθηκε παραπάνω. Έτσι, η ηλεκτρόφιλη προσθήκη υδροβρωμικού οξέος σε προπένιο θα έχει ως αποτέλεσμα τον σχηματισμό 2-βρωμοπροπανίου. Ένα ενδιάμεσο κατιόν με θετικό φορτίο σε ένα κεντρικό άτομο άνθρακα είναι πιο σταθερό από ένα carbocation με ένα θετικό φορτίο στο ακραίο άτομο. Ως αποτέλεσμα, το άτομο βρωμίου αλληλεπιδρά με το δεύτερο άτομο άνθρακα.
Επίδραση του υποκαταστάτη που αποσύρει ηλεκτρόνια στην πορεία της αλληλεπίδρασης
Εάν το μόριο προέλευσης περιέχειυποκαταστάτης που έλκει ηλεκτρόνια έχουν αρνητικό επαγωγικό και / ή μεσομερείς επίδραση, ηλεκτρονιόφιλη προσθήκη είναι ενάντια στους παραπάνω κανόνες. Παραδείγματα τέτοιων υποκαταστατών: CF3, COOH, CN.Σε αυτή την περίπτωση, η μεγάλη απόσταση του θετικού φορτίου από την ομάδα που αποσύρεται από ηλεκτρόνια καθιστά την πρωτογενή καρβοκατασκευή πιο σταθερή. Ως αποτέλεσμα, το υδρογόνο συνδυάζεται με ένα λιγότερο υδρογονωμένο άτομο άνθρακα.
Η γενική παραλλαγή του κανόνα θα μοιάζει με αυτό: όταν ένα ασύμμετρο αλκενίου και ένα ασύμμετρο αντιδραστήριο αλληλεπιδρούν, η αντίδραση προχωρά κατά μήκος της διαδρομής σχηματισμού της πιο σταθερής καρβοκατασκευής.